澳門大學的研究團隊研發了一種新技術,結合納米粒子、細菌膜和免疫細胞的力量,將藥物遞送到腫瘤,從而攻擊癌細胞。在超分子化學專家、澳大中華醫藥研究院、中藥質量研究國家重點實驗室副教授王瑞兵帶領下,團隊期望研發成本更低、效果更佳的個性化癌症療法。
用於藥物靶向遞送的超分子智能生物材料
王教授在2014年加入澳大,專長於超分子化學、超分子生物材料、放射性藥物和分子醫學影像等領域,2020年當選英國皇家化學會會士。他主要研究分子之間如何以非共價鍵方式產生相互作用和自我組裝,從而成為簡單、智能和具生物活性的「超分子」結構,好比牽手的分子體系。這方面的研究使科學家能按需要設計分子結構,例如藥物和健康產品。
追擊實體瘤組織
王教授指出,部分抗癌藥物常在到達腫瘤組織前已被體內的非癌組織或細胞所吸收,結果對身體產生了副作用而療效甚微。
為解決這個難題,科學家開發了各種方法,將藥物和納米藥物遞送到腫瘤。其中一個方法是運用患者體內容易被腫瘤組織所「招募」的細胞。科學家可以取出這些細胞,在無菌環境下修飾它們或放入藥物,再將細胞放回體內,通過靶向遞送來協助殲滅癌細胞。然而,這種做法通常昂貴而費時,也有細胞在體外被污染的風險。因此,王教授的研究團隊開發了一種方法,讓納米藥物在體內搭上「巨噬細胞順風車」,利用巨噬細胞(一種免疫細胞)的炎症趨向性前往腫瘤組織。
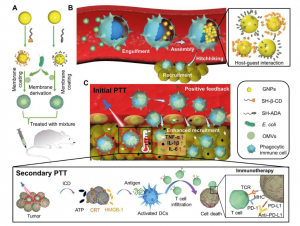
具體而言,研究團隊設計出一款超分子納米藥物。這種藥物以大環化合物(β-環糊精)為主體分子,以金剛烷作為客體分子,它們分別用於修飾金納米粒子(一種常用於腫瘤診療的納米藥物)的表面。
為了製備這些超分子納米藥物,研究團隊先用大腸桿菌的外膜囊泡,分別包裹經β-環糊精和金剛烷所修飾的金納米粒子。這些外膜囊泡一方面作為保護屏障,避免金納米粒子在進入患者體內前過早地因為β-環糊精與金剛烷的主客體作用而相互結合。另一方面,這些外膜囊泡也可使納米藥物擁有「仿細菌」特性。仿細菌的納米藥物一旦被靜脈注射到患者體內,就會被巨噬細胞當作細菌而「內吞」。這些免疫細胞有炎症趨向性,會自然在腫瘤組織聚集。
巨噬細胞吞下納米藥物後,大腸桿菌外膜囊泡會被巨噬細胞本身的溶酶體酶所分解,使經β-環糊精和金剛烷所修飾的金納米粒子通過「牽手」(即「超分子主客體相互作用」)組裝成超分子聚集體。王教授說:「腫瘤組織是目的地,巨噬細胞就是順風車,超分子藥物則是乘客。沒有順風車的話,乘客恐怕難以順利找到目的地。」
光熱腫瘤治療
在巨噬細胞內,由於這些金納米粒子的表面會緊密接觸,它們會通過「等離子體效應」而獲得光熱性質,即被光照射時會發熱。當癌細胞附近有足夠的納米藥物聚集,醫生可以採用「光熱療法」,引導特定波長的光到腫瘤,產生高溫來破壞腫瘤組織和細胞。
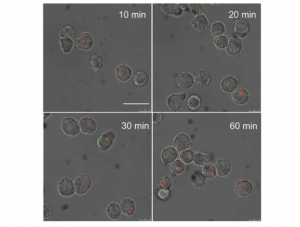
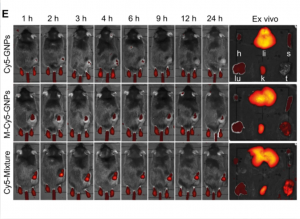
研究團隊為驗證仿細菌納米藥物的效力,對三組實驗鼠採用光熱治療。這些實驗鼠均患有黑色素瘤(一種皮膚癌)。第一組僅使用沒有外膜囊泡包裹的金納米粒子;第二組使用有外膜囊泡包裹的金納米粒子;第三組使用由外膜囊泡包裹、分別經主體分子和客體分子所修飾的金納米粒子。
實驗結果顯示,經注射這些藥物後,第一組小鼠的腫瘤中積累了最少量的金納米粒子;由於第二組小鼠使用的藥物採用基於仿細菌的巨噬細胞搭便車方式進行遞送,它們的腫瘤中積累了較多的金納米粒子;第三組小鼠則因金納米粒子在巨噬細胞內形成超分子聚集,使得藥物經過巨噬細胞搭便車遞送時的早期流失減到最小,因此在腫瘤組織中大量積累。當用激光照射時,第三組小鼠的實體腫瘤組織達到了非常高的溫度,但除了腫瘤外,周圍組織沒有明顯的損傷,再次表明大部分超分子納米藥物已經到達了其預定目標:腫瘤組織。相反,其他兩組小鼠的腫瘤部位只顯示出非常溫和的升溫。因此,當仿細菌超分子納米藥物與抗PD-L1(一種免疫檢查點抑制劑)相結合時,它對黑色素瘤能發揮最佳的療效,幾乎將小鼠的全部腫瘤消除。
進一步驗證和開發
這項研究在2022年於知名學術期刊《科學進展》發表,題為《細菌仿生納米藥物介導的免疫細胞內組裝體的構建及其搭便車式靶向抗腫瘤免疫治療》。論文的通訊作者為王瑞兵教授,共同通訊作者為澳大中華醫藥研究院特聘教授李銘源,博士後研究員高成和碩士生王慶福為文章的共同第一作者。澳大博士生李俊燕和鄺熙婷、研究助理韋健文、博士後研究員謝貝貝等人也對此研究作出重要貢獻。這項研究由何鴻燊博士醫療拓展基金、國家自然科學基金、澳門特別行政區科學技術發展基金和國家教育部澳大精準腫瘤學前沿科學中心資助。
這項研究亦在2022年粵港澳大灣區高價值專利培育佈局大賽中從數千個項目中脫穎而出,獲頒銀獎,而該大賽只有25個項目獲金獎或銀獎。這項研究引起不少內地企業的關注。他們正與團隊討論進一步開發這項技術,以及深入驗證其功效和安全性。
以超分子技術改良各類治療
王教授的團隊近年開展了多項基於超分子技術在智能藥物遞送上的前沿應用研究,上述癌症藥物遞送技術只是其中之一。例如,他們也開發了一種針對急性肺炎的技術,使藥物更有效地遞送到發炎的肺部,做法是將β-環糊精錨定在紅細胞(又稱紅血球)上、將二茂鐵錨定在納米藥物的表面,並使兩者產生超分子作用,讓藥物搭上紅細胞的順風車到肺部。王教授說:「紅細胞生物相容性高,在體內血液循環的時間長,是持續遞送藥物的理想載體。」研究團隊發現,以這種方式遞送薑黃素可以有效治療小鼠的急性肺炎。
此外,超分子技術可以用於控制體內和體外出血。王教授說,創傷後或手術時過度出血是對人類生命的一大威脅,常見的應對方法是輸送含豐富血小板的血漿,藉以凝結受損的血管,但這些血小板往往無法迅速抵達出血位置。因此,他的團隊運用葫蘆脲[7]與其它化合物之間的超分子作用,將普通的血小板改良為「超分子工程化的血小板」,提升其對受傷血管的靶向性和凝血能力。在實驗鼠身上,相比普通血小板,經改良的血小板能顯著減少出血時間和出血量。
超分子化學的核心是研究分子之間獨特的非共價鍵作用,例如靜電和疏水效應,成果早已廣泛應用於日常生活用品,其在生物醫藥中和生物材料中的應用有非常大的潛力。王教授說:「持續研究超分子系統將有助我們設計出更智能、功能更多的分子結構,更好地滿足生物醫藥方面的需要。微小的超分子能為人類解決巨大的難題。它們遞送的不單是藥物,還有源源不絕的想法和解決方案。」
來源:《澳大新語》第27期